삼성바이오에피스, ‘스텔라라 시밀러’ 시장 선점 박차… “국내 첫 허가에 유럽 출시 임박”
- 동아경제
-
입력 2024년 4월 12일 14시 27분
공유하기
글자크기 설정
삼성바이오에피스 ‘에피즈텍’ 식약처 품목허가
정맥주사·피하주사(SC) 2개 제형 국내 허가
지난 2월 유럽서 허가권고
셀트리온·동아ST도 글로벌 허가 절차 돌입
美서 내년 삼성바이오에피스·셀트리온·동아ST 순 출시 전망
삼성바이오에피스는 11일 식품의약품안전처로부터 자가면역질환 치료제 스텔라라 바이오시밀러 ‘에피즈텍(EPYZTEK, 개발명 SB17, 성분명 우스테키누맙)’ 품목허가를 국내 최초로 획득했다고 12일 밝혔다.
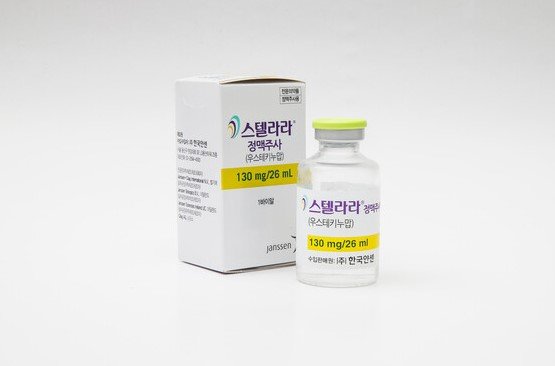
오리지널 의약품인 스텔라라는 얀센(Janssen)이 개발한 글로벌 블록버스터 제품이다. 연간 글로벌 매출은 약 14조 원 규모다. 자가면역 관련 염증성 사이토카인의 한 종류인 인터루킨(IL)-12·23의 활성을 억제하는 기전을 가진다. 판상 건선과 건선성 관절염, 크론병, 궤양성 대장염 등을 치료하는데 사용된다.
삼성바이오에피스의 경우 이번에 정맥주사(Ⅳ)제형과 피하주사(SC)제형 두 종에 대한 품목허가를 받았다. 정맥주사제형은 성인 크론병과 궤양성 대장염을 적응증으로 하고 SC제형(에피즈텍프리필드주)은 성인 대상으로는 판상 건선, 건선성 관절염, 크론병, 궤양성 대장염 등이고 소아 환자에 대해서는 판상 건성 적응증을 확보했다. 이번 품목허가로 삼성바이오에피스는 자가면역질환 치료제 포트폴리오에 인터루킨 억제제를 처음으로 추가하게 됐다. 종양괴사인자 알파(TNF-α) 억제제 계열 3종(에톨로체, 레마로체, 아달로체)에 이어 4번째로 개발에 성공한 자가면역질환 치료제다.

정병인 삼성바이오에피스 RA(Regulatory Affairs)팀장 상무는 “국내에서 처음으로 스텔라라 바이오시밀러 품목허가를 획득해 환자에게 새로운 치료 옵션을 제공할 수 있게 됐다”며 “해외 출시 준비도 순항 중인 상태로 보다 많은 환자들이 새 치료 옵션에 따른 치료 혜택을 누릴 수 있기를 기대한다”고 말했다.
한편 삼성바이오에피스는 지난 2021년 7월부터 2022년 11월까지 국내를 비롯해 총 8개국 판상 건선 환자 503명을 대상으로 SB17(스텔라라 바이오시밀러) 임상 3상을 진행했다. 이를 통해 오리지널 의약품 대비 유효성과 안전성 등 임상학적 동등성을 확인했다.
© dongA.com All rights reserved. 무단 전재, 재배포 및 AI학습 이용 금지
트렌드뉴스
-
1
“핵폭탄 11개분 우라늄 제거” 美항공기 100대-2400명 투입하나
-
2
성토 쏟아져도 침묵한 장동혁, 절윤 결의문엔 대변인 짧은 입장만
-
3
‘도쿄의 기적’ 韓, 경우의 수 뚫고 17년만에 WBC 8강
-
4
쇼핑몰 3층서 화분 투척 아찔…웃으며 달아난 범인 정체는?
-
5
‘음주운전’ 배성우, 영화 7년만의 개봉에 고개 숙였다…“다시한번 사과”
-
6
주변 ‘이런 사람’ 있으면 빨리 늙는다…부모·자식이 골칫거리? [노화설계]
-
7
“175명 폭사 이란 초교 인근, 美토마호크 추정 미사일 떨어져”
-
8
한동훈 자객이 장예찬? 부산 북구갑 4자 대결 구도 펼쳐지나[정치를 부탁해]
-
9
미군 유해 송환식서 흰색 야구모자 쓴 트럼프, 부적절 논란
-
10
G마켓, ‘스타배송’ 경쟁력 키운다… 풀필먼트 협력사에 ‘위킵’ 신규 선정
-
1
국힘 공관위, 오세훈 겨냥 “후보 없더라도 공천 기강 세울 것”
-
2
의총서 침묵한 장동혁…‘절윤 결의문’엔 “총의 존중”
-
3
[천광암 칼럼]“尹이 계속했어도 주가 6,000”… 정말 가능했을까
-
4
李 “빈대 잡자고 초가삼간 태우는 개혁은 안돼”…추미애 법사위 겨냥?
-
5
빗장풀린 주한미군 무기 차출… “통보-협의 절차도 축소할듯”
-
6
李 “정유사·주유소 담합과 매점매석, 이익의 몇배로 엄정 제재”
-
7
성토 쏟아져도 침묵한 장동혁, 절윤 결의문엔 대변인 짧은 입장만
-
8
이란 “최고지도자로 모즈타바 선출”…美와 화해 멀어졌다
-
9
마감까지 공천신청 안한 오세훈… 吳측 “중대결단 배제 안해”
-
10
“자식이 부모 모실 필요 없다” 48%…18년만에 두 배로
트렌드뉴스
-
1
“핵폭탄 11개분 우라늄 제거” 美항공기 100대-2400명 투입하나
-
2
성토 쏟아져도 침묵한 장동혁, 절윤 결의문엔 대변인 짧은 입장만
-
3
‘도쿄의 기적’ 韓, 경우의 수 뚫고 17년만에 WBC 8강
-
4
쇼핑몰 3층서 화분 투척 아찔…웃으며 달아난 범인 정체는?
-
5
‘음주운전’ 배성우, 영화 7년만의 개봉에 고개 숙였다…“다시한번 사과”
-
6
주변 ‘이런 사람’ 있으면 빨리 늙는다…부모·자식이 골칫거리? [노화설계]
-
7
“175명 폭사 이란 초교 인근, 美토마호크 추정 미사일 떨어져”
-
8
한동훈 자객이 장예찬? 부산 북구갑 4자 대결 구도 펼쳐지나[정치를 부탁해]
-
9
미군 유해 송환식서 흰색 야구모자 쓴 트럼프, 부적절 논란
-
10
G마켓, ‘스타배송’ 경쟁력 키운다… 풀필먼트 협력사에 ‘위킵’ 신규 선정
-
1
국힘 공관위, 오세훈 겨냥 “후보 없더라도 공천 기강 세울 것”
-
2
의총서 침묵한 장동혁…‘절윤 결의문’엔 “총의 존중”
-
3
[천광암 칼럼]“尹이 계속했어도 주가 6,000”… 정말 가능했을까
-
4
李 “빈대 잡자고 초가삼간 태우는 개혁은 안돼”…추미애 법사위 겨냥?
-
5
빗장풀린 주한미군 무기 차출… “통보-협의 절차도 축소할듯”
-
6
李 “정유사·주유소 담합과 매점매석, 이익의 몇배로 엄정 제재”
-
7
성토 쏟아져도 침묵한 장동혁, 절윤 결의문엔 대변인 짧은 입장만
-
8
이란 “최고지도자로 모즈타바 선출”…美와 화해 멀어졌다
-
9
마감까지 공천신청 안한 오세훈… 吳측 “중대결단 배제 안해”
-
10
“자식이 부모 모실 필요 없다” 48%…18년만에 두 배로
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0