공유하기
셀트리온, 코로나19 치료제 국내 허가 신청…1월 중 미국·유럽 도전
- 뉴스1
-
입력 2020년 12월 29일 14시 17분
글자크기 설정
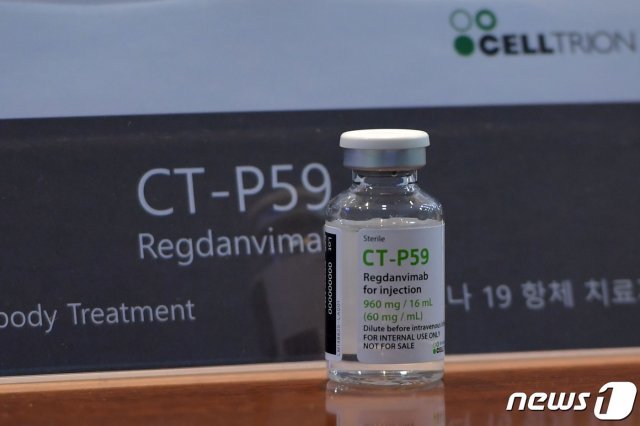
셀트리온은 29일 식품의약품안전처에 신종 코로나바이러스 감염증(코로나19) 항체 치료제 ‘CT-P59(성분명:레그단비맙·Regdanvimab)’의 국내 조건부 사용 승인을 신청했다고 밝혔다.
이번 조건부 사용 승인 신청은 CT-P59의 글로벌 임상 2상 결과를 바탕으로 진행된 것이다. CT-P59 임상 2상은 대한민국, 루마니아, 스페인, 미국에서 총 327명의 환자가 참여해 지난 11월 25일 최종 투약을 완료했다.
셀트리온 자체 평가에서는 코로나19 경증 환자를 대상으로 투약 안전성과 약물 유효성이 충분히 확보된 것으로 나타났다. 단, 식약처 심사 결과가 나오기 전까지 임상 2상 결과는 별도로 공개하지 않는다. 셀트리온은 심사 이후 관련 학회에서 결과를 발표할 예정이다.
특히 코로나19 완치자의 혈액에서 항체를 지속적으로 채취할 필요 없이 유전자 재조합된 세포를 이용해 중화항체를 대량 생산할 수 있는 것이 장점이다. 경증부터 중등증까지의 코로나19 환자를 대상으로 90분간 정맥 투여한다.
기존에 허가된 ‘베클루리주’(렘데시비르)는 세포 내 감염된 코로나19 바이러스의 복제를 억제하는 반면, ‘렉키로나주(레그단비맙)’는 코로나19 바이러스의 표면에 있는 인체 세포 결합 부위(Receptor Binding Domain)에 항체치료제가 대신 결합해 바이러스의 세포 침투를 막는다.
셀트리온은 국내 조건부 허가 신청과 함께 해외 긴급사용승인 절차도 추진한다. 미국 FDA 및 유럽 EMA(유럽의약품청)와 이번 임상 2상 결과 데이터를 상세히 공유하면서 승인신청서 제출 관련 협의를 개시하고 내년 1월중 이들 국가 대부분에 신청서를 제출할 계획이다.
(서울=뉴스1)
코로나 재확산 >
구독
트렌드뉴스
-
1
트럼프 “내가 너무 친절했다…관세 훨씬 더 높일수 있다” 으름장
-
2
“뱀이다” 강남 지하철 화장실서 화들짝…멸종위기 ‘볼파이톤’
-
3
李 “한국인 건들면 패가망신, 빈말 같나”…캄보디아어로도 경고
-
4
“폭설 속 96시간” 히말라야서 숨진 주인 지킨 핏불
-
5
월 300만원 줘도 “공무원은 싫어요”…Z세대 82% ‘의향 없다’
-
6
美 이민단속에 예산 펑펑…“32조 떼돈 벌었다” 웃는 기업 어디?
-
7
‘사우디 방산 전시회’ 향하던 공군기, 엔진 이상에 日 비상착륙
-
8
[동아광장/박용]이혜훈 가족의 엇나간 ‘대한민국 사용설명서’
-
9
국방부, 계엄 당일 국회 침투한 김현태 前707단장 파면
-
10
윤주모, 편의점 덮밥 부실 논란 해명…“맛없어 보이게 찍어”
-
1
장동혁, 강성 지지층 결집 선택… 오세훈도 나서 “張 물러나라”
-
2
[사설]장동혁, 한동훈 제명… 공멸 아니면 자멸의 길
-
3
오세훈 “장동혁 물러나야” 직격…지방선거 전열 흔들리는 국힘
-
4
李 “한국인 건들면 패가망신, 빈말 같나”…캄보디아어로도 경고
-
5
“장동혁 재신임 물어야” “모든게 張 책임이냐”…내전 격화
-
6
트럼프 “내가 너무 친절했다…관세 훨씬 더 높일수 있다” 으름장
-
7
李, ‘로봇 반대’ 현대차 노조 향해 “거대한 수레 피할 수 없어”
-
8
한동훈 다음 스텝은…➀법적 대응 ➁무소속 출마 ➂신당 창당
-
9
李, 로봇 도입 반대한 현대차노조 겨냥 “거대한 수레 피할수 없다”
-
10
부동산 정책 “잘못한다” 40%, “잘한다” 26%…李지지율 60%
트렌드뉴스
-
1
트럼프 “내가 너무 친절했다…관세 훨씬 더 높일수 있다” 으름장
-
2
“뱀이다” 강남 지하철 화장실서 화들짝…멸종위기 ‘볼파이톤’
-
3
李 “한국인 건들면 패가망신, 빈말 같나”…캄보디아어로도 경고
-
4
“폭설 속 96시간” 히말라야서 숨진 주인 지킨 핏불
-
5
월 300만원 줘도 “공무원은 싫어요”…Z세대 82% ‘의향 없다’
-
6
美 이민단속에 예산 펑펑…“32조 떼돈 벌었다” 웃는 기업 어디?
-
7
‘사우디 방산 전시회’ 향하던 공군기, 엔진 이상에 日 비상착륙
-
8
[동아광장/박용]이혜훈 가족의 엇나간 ‘대한민국 사용설명서’
-
9
국방부, 계엄 당일 국회 침투한 김현태 前707단장 파면
-
10
윤주모, 편의점 덮밥 부실 논란 해명…“맛없어 보이게 찍어”
-
1
장동혁, 강성 지지층 결집 선택… 오세훈도 나서 “張 물러나라”
-
2
[사설]장동혁, 한동훈 제명… 공멸 아니면 자멸의 길
-
3
오세훈 “장동혁 물러나야” 직격…지방선거 전열 흔들리는 국힘
-
4
李 “한국인 건들면 패가망신, 빈말 같나”…캄보디아어로도 경고
-
5
“장동혁 재신임 물어야” “모든게 張 책임이냐”…내전 격화
-
6
트럼프 “내가 너무 친절했다…관세 훨씬 더 높일수 있다” 으름장
-
7
李, ‘로봇 반대’ 현대차 노조 향해 “거대한 수레 피할 수 없어”
-
8
한동훈 다음 스텝은…➀법적 대응 ➁무소속 출마 ➂신당 창당
-
9
李, 로봇 도입 반대한 현대차노조 겨냥 “거대한 수레 피할수 없다”
-
10
부동산 정책 “잘못한다” 40%, “잘한다” 26%…李지지율 60%
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0