이뮨온시아, PD-L1 억제 면역항암제 2상 임상시험계획 승인
- 동아경제
-
입력 2020년 5월 21일 21시 58분
공유하기
글자크기 설정
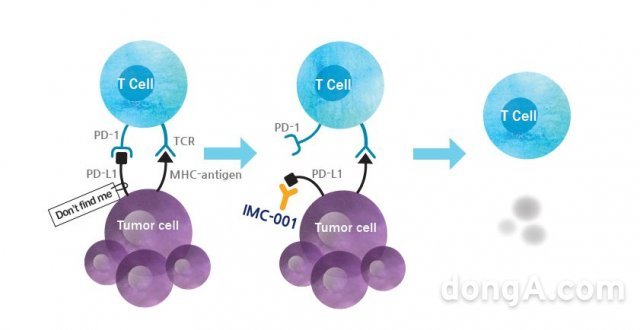
유한양행 계열 면역항암제 연구·개발 전문업체 이뮨온시아는 면역항암제 후보물질 ‘IMC-001’이 식품의약품안전처(식약처)로부터 임상 2상 시험계획을 최종 승인 받았다고 21일 밝혔다. 해당 임상 2상은 재발성 또는 불응성 비강형 결절외 NK/T세포 림프종 환자를 대상으로 진행될 예정이다.
IMC-001은 T세포의 PD-1과 암세포의 PD-L1간 상호작용에 의한 항암T세포의 억제신호를 차단해 항암T세포 활성을 촉진시키고 항암효과를 높이는 면역관문억제제(Immune Checkpoint Inhibitor)다. 작년 기준 25조 원 넘는 매출을 발생시킨 키트루다, 옵디보 등 PD-1/PD-L1 계열 약물들과 동일한 작용기전이지만 IMC-001의 경우 여기에 Fc 기능을 살린 IgG1타입을 적용해 NK세포 등 다른 면역세포도 함께 암세포를 공격하도록 한다. 보다 높은 항암효과를 기대할 수 있는 방식이라고 이뮨온시아 측은 설명했다.
NK/T 세포 림프종은 희귀 림프종으로 엡스타인바 바이러스(EBV, 인간 헤르페스바이러스 4형) 감염과 연관돼 발생하는 것으로 알려졌다. 신약개발 수요가 매우 높은 암종으로 아시아에서 특히 발생율이 높은 것으로 전해진다. PD-1/PD-L1계열 약물의 바이오마커로 자주 사용되는 PD-L1을 발현하는 환자 비율이 높다는 특징이 있어 높은 치료 효과가 기대된다고 회사 측은 전했다.
송윤정 이뮨온시아 대표는 “IMC-001은 표준치료법에 실패한 말기 암 환자들을 대상으로 한 임상 1상에서 용량제한 독성 반응(dose limiting toxicity)이 관찰되지 않았고 일부 환자에서 생존기간 연장 효과 및 종양 크기가 줄어드는 반응이 있는 등 매우 고무적인 결과를 보였다”며 “미충족수요(Unmet medical needs)가 높은 NK/T세포 림프종 환자들에게 하루 빨리 보다 효과적인 치료제를 제공하기 위해 최선을 다하겠다”고 말했다.
IMC-001은 미국 소렌토테라퓨틱스의 G-MAB 항체 라이브러리로부터 도출된 약물이다. 국내에서 개발되고 있는 첫 PD-1/PD-L1계열 약물이다. 다른 PD-1/PD-L1계열 약물의 경우 치료가격이 매우 높다는 단점이 있다. IMC-001은 우수한 약효를 보이는 면역항암제를 보다 많은 암 환자들에게 접근 가능한 가격에 공급하는 것을 목표로 개발이 진행되고 있다.
이뮨온시아는 유한양행과 소렌토가 지난 2016년 설립한 합작법인이다. 글로벌 라이선스 아웃을 목표로 두고 다양한 면역항암제의 전임상 및 임상 개발에 주력하고 있다. 개발 중인 신약 후보물질 중 IMC-002(CD47억제제)에 대한 임상 1상 시험계획이 최근 미국 식품의약국(FDA)로부터 승인 받았다.
트렌드뉴스
-
1
트럼프 손녀 “파산하겠네” 전쟁중 초고가 쇼핑…미국인들 뿔났다
-
2
“20억 줄테니 팔라”…中도 탐낸 ‘서해의 독도’ 격렬비열도
-
3
포스코-쿠팡-현대차…노란봉투법 첫날, 하청노조 원청교섭 요구 봇물
-
4
美국방 “오늘 이란 공습 가장 격렬할 것…전투기·폭격기 최대 투입”
-
5
‘이란의 영변’에 농축우라늄 60% 저장…美, 델타포스 투입하나
-
6
장동혁, ‘후보 미등록’ 김태흠 찾아가 “공천 신청해달라”
-
7
삼성전자 16조 자사주 상반기 소각…SK㈜도 5.1조
-
8
젤렌스키 “軍에 주소 넘긴다” 친러 헝가리 총리 위협
-
9
푸틴, 트럼프와 1시간 통화 “이란전 끝내라”… 中, 걸프국 접촉 확대
-
10
‘음주운전’ 이재룡 “잘못된 행동 죄송…사고 인지 못해”
-
1
장동혁 “의원들 의견 잘 들었다”…‘절윤’ 입장 이틀째 침묵
-
2
李 “주한미군 무기 반출, 반대의견 내지만 관철 어려워”
-
3
한동훈 “尹 복귀 반대 결의?…어차피 감옥 있는데 그게 절연인가”
-
4
대북송금 검사 “檢지휘부 믿다 나는 죽고 사건은 취소될 판”
-
5
‘찐명’ 한준호, 김어준 직격 “지라시도 안되는 음모론으로 李정부 공격”
-
6
성토 쏟아져도 침묵한 張, 절윤 결의문엔 대변인 짧은 입장만
-
7
1인당 국민총소득 12년째 제자리…日·대만에 추월당했다
-
8
전한길 “내 덕에 대표 된 장동혁, 윤어게인이냐 절윤이냐 밝혀라”
-
9
李 “개혁하자고 초가삼간 태우면 안돼” 檢개혁 정부 주도 못박아
-
10
“20억 줄테니 팔라”…中도 탐낸 ‘서해의 독도’ 격렬비열도
트렌드뉴스
-
1
트럼프 손녀 “파산하겠네” 전쟁중 초고가 쇼핑…미국인들 뿔났다
-
2
“20억 줄테니 팔라”…中도 탐낸 ‘서해의 독도’ 격렬비열도
-
3
포스코-쿠팡-현대차…노란봉투법 첫날, 하청노조 원청교섭 요구 봇물
-
4
美국방 “오늘 이란 공습 가장 격렬할 것…전투기·폭격기 최대 투입”
-
5
‘이란의 영변’에 농축우라늄 60% 저장…美, 델타포스 투입하나
-
6
장동혁, ‘후보 미등록’ 김태흠 찾아가 “공천 신청해달라”
-
7
삼성전자 16조 자사주 상반기 소각…SK㈜도 5.1조
-
8
젤렌스키 “軍에 주소 넘긴다” 친러 헝가리 총리 위협
-
9
푸틴, 트럼프와 1시간 통화 “이란전 끝내라”… 中, 걸프국 접촉 확대
-
10
‘음주운전’ 이재룡 “잘못된 행동 죄송…사고 인지 못해”
-
1
장동혁 “의원들 의견 잘 들었다”…‘절윤’ 입장 이틀째 침묵
-
2
李 “주한미군 무기 반출, 반대의견 내지만 관철 어려워”
-
3
한동훈 “尹 복귀 반대 결의?…어차피 감옥 있는데 그게 절연인가”
-
4
대북송금 검사 “檢지휘부 믿다 나는 죽고 사건은 취소될 판”
-
5
‘찐명’ 한준호, 김어준 직격 “지라시도 안되는 음모론으로 李정부 공격”
-
6
성토 쏟아져도 침묵한 張, 절윤 결의문엔 대변인 짧은 입장만
-
7
1인당 국민총소득 12년째 제자리…日·대만에 추월당했다
-
8
전한길 “내 덕에 대표 된 장동혁, 윤어게인이냐 절윤이냐 밝혀라”
-
9
李 “개혁하자고 초가삼간 태우면 안돼” 檢개혁 정부 주도 못박아
-
10
“20억 줄테니 팔라”…中도 탐낸 ‘서해의 독도’ 격렬비열도
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개

![‘한 아비는 열 아들을 길러도…’[횡설수설/이진영]](https://dimg.donga.com/a/464/260/95/1/wps/NEWS/FEED/Donga_Home_News2/133504252.3.thumb.jpg)

댓글 0