공유하기
[理知논술/교과서 심화학습]콩-치즈 함께 먹으면 왜 안좋을까
-
입력 2008년 1월 14일 02시 58분
글자크기 설정

[풀이]
신장의 결석은 남자들에게 쉽게 찾아오는 질환이다. 신장 결석이란 신장의 내부에 생기는 결석을 말하는데, 이것은 앙금 생성 반응의 결과라고 생각할 수 있다.
소변에는 여러 가지 이온들이 용해되어 있고, 이들이 어떤 원인에 의해 균형을 잃으면 앙금을 생성하는 반응이 일어날 수 있다. 결석의 성분은 여러 가지가 있는데 주로 옥살산칼슘(CaC₂O₄)이나 인산칼슘[Ca₃(PO₄)₂]이 많다고 한다. 옥살산칼슘이란 칼슘 이온(Ca²+)과 옥살산이온(C₂O²-₄)이 반응하여 생성된 앙금이다.
Ca²+ + C₂O²-₄ → CaC₂O₄
영양분이 많이 들어 있는 시금치를 날로 먹지 말라는 식품 영양학자들의 충고가 있다. 이것은 시금치 속에 옥살산이 많이 포함되어 있어, 칼슘과 반응하여 물에 녹지 않는 앙금을 생성하기 때문이다. 두부와 시금치가 궁합이 맞지 않는다고 하는 이유도 여기에 있다. 그러나 시금치를 데쳐 익히면 옥살산이 분해되어 큰 문제가 없다고 한다.
궁합이 맞지 않는 음식으로 콩과 치즈가 있다. 단백질과 지방이 풍부한 영양식으로 아이들이 좋아하는 치즈 100g에는 칼슘이 600mg 이상 들어 있고, 콩도 고단백, 고지방 식품이기는 하나 칼슘보다 인산의 함량이 월등히 많다. 콩과 치즈를 함께 먹으면 콩의 인산 이온(PO²-₄)과 치즈의 칼슘이온(Ca²+)이 반응하여 물에 녹지 않는 Ca₃(PO₄)₂이 생성되기 때문에 콩과 치즈를 함께 먹는 것은 좋지 않다.
3Ca²+ + 2PO²-₄ → Ca₃(PO₄)₂
[심화탐구 문제 2] 염화나트륨을 가열하여 녹이면 양이온과 음이온이 각각 한 종류씩만 존재하므로 이들 양이온과 음이온이 각 전극에서 산화·환원반응을 하게 된다. 그러면 K+과 NO₃- 뿐만 아니라 H+과 OH-이 함께 들어 있는 질산칼륨 수용액을 전기분해하면 각 전극에서는 각각 어떤 물질이 생성될지 생각해 보고 이유를 설명하시오.(대한교과서 화학2)
[풀이]
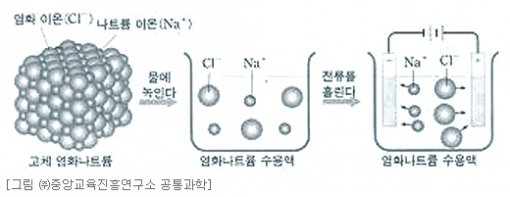
고체 상태의 NaCl 결정은 양이온과 음이온이 강하게 결합하여 있어서 전기적으로 중성이지만 물에 녹으면 양이온과 음이온으로 각각 나누어진다. 전해질 수용액에 전극을 넣어 전류를 흐르게 하면 양이온은 (-)극으로, 음이온은 (+)극으로 이동하여 전류가 흐르게 된다.
전자를 잃는 반응을 산화반응이라고 하고, 전자를 얻는 반응을 환원반응이라고 한다.
전기분해 반응에서 (+)극에서는 음이온이 끌려가 전자를 잃고 중성물질이 되는 반응이 일어나므로 산화반응이 일어나고, (-)극에서는 양이온이 끌려가 전자를 얻어 중성물질이 되는 환원반응이 일어난다. 전기분해 장치에서는 산화반응이 일어나는 (+)전극을 산화전극, 환원반응이 일어나는 (-)전극을 환원전극이라 한다.
용융염의 전기분해에서 음이온은 전지의 (+)극에 연결된 전극 쪽으로 끌려가서 전자를 잃고 산화된다. 양이온은 전자의 (-)극에 연결된 전극 쪽으로 끌려가서 전지에서 나온 전자를 받아 환원된다. 예를 들어 염화나트륨 용융염의 전기분해 반응에서 (+)극에서는 Cl-이 끌려가 전자를 잃고 Cl₂가 발생하고, (-)극에서는 Na+이 끌려가 전자를 얻어 Na가 석출된다.
(+)극 (산화전극): 2Cl-(aq) → Cl₂(g) + 2e-
(-)극 (환원전극): 2Na+(aq) + 2e- → Na(s)
염화나트륨의 용융 전기분해의 경우와 달리, 염화나트륨 수용액의 전기분해에서는 물도 함께 전기분해가 된다. 염화나트륨 수용액을 전기분해할 때 각 전극에서 일어나는 변화는 다음과 같다.
(+)극 (산화전극): 2Cl-(aq) → Cl₂(g) + 2e-
(-)극 (환원전극): 2H₂o(l) + 2e- → H₂(g) + 2OH-(aq)
일반적으로 전해질 속에 Li+, K+, Ca²+, Na+, Mg²+, Al³+과 같이 반응성이 커서 양이온으로 있고자 하는 경향이 큰 이온은 환원되지 않고 대신 물이 환원되어 (-)극에서 H₂가 발생한다. 또한 전해질 속에 F-, SO²-₄, PO³-₄, CO²-₃, NO₃- 등의 음이온들은 산화되지 않아 (+)극에서 물이 산화되어 O₂기체가 발생하게 된다.
즉 (-)극에서는 Na+대신 물이 환원되어 수소 기체와 함께 OH-이 생성되며 (-)극 주위에 OH-가 생성되기 때문에 전극 주위는 염기성이 된다.
질산칼륨(KNO₃) 수용액의 전기분해에서는 K+과 NO₃-은 이온으로 있고자 하는 경향이 커서 산화·환원반응이 일어나지 않는다. 그러므로 (+)극과 (-)극에 모두 물이 반응하여, (+)극에서는 산소기체가 발생하고, (-)극에서는 수소기체가 발생한다.
(+)극 (산화전극) : 2H₂O(l) → O₂(g) + 4H+(aq) + 4e-
(-)극 (환원전극) : 4H₂O(l) + 4e-→ 2H₂(g) + 4OH-(aq)
오승헌 청솔학원 과학논술 강사
트렌드뉴스
-
1
홍준표 “김건희 도이치 굳이 무죄? 정치판 모르는 난해한 판결”
-
2
유엔사 “DMZ법, 정전협정서 韓 빠지겠다는것” 이례적 공개 비판
-
3
“담배 끊으면 60만 원”… 보건소 맞춤형 금연 코칭
-
4
장동혁, 결국 한동훈 제명…국힘 내홍 격랑속으로
-
5
배우 얼굴 가린다고…아기 폭우 맞히며 촬영, ‘학대’ 논란
-
6
화장실 두루마리 휴지는 ‘이 방향’이 맞는 이유
-
7
[속보]용산-태릉-과천 등 수도권 51곳에 6만채 공급
-
8
오천피 시대 승자는 70대 이상 장기 투자자… 20~30대 수익률의 2배
-
9
[단독]“구글스토어에 버젓이 ‘피싱 앱’, 2억 날려”… 신종 앱사기 기승
-
10
“中여성 2명 머문뒤 객실 쑥대밭”…日호텔 ‘쓰레기 테러’ [e글e글]
-
1
장동혁, 결국 한동훈 제명…국힘 내홍 격랑속으로
-
2
李 “담배처럼 ‘설탕세’ 거둬 공공의료 투자…어떤가요”
-
3
[속보]장동혁 국힘 지도부, 한동훈 제명 확정
-
4
법원 “김건희, 청탁성 사치품으로 치장 급급” 징역 1년8개월
-
5
李 ‘설탕 부담금’ 논의 띄우자…식품업계 “저소득층 부담 더 커져”
-
6
[단독]조여오는 25% 관세… “美 관보 게재 준비중”
-
7
홍준표 “김건희 도이치 굳이 무죄? 정치판 모르는 난해한 판결”
-
8
김종혁 “친한계 탈당 없다…장동혁 체제 오래 못갈것”[정치를 부탁해]
-
9
“中여성 2명 머문뒤 객실 쑥대밭”…日호텔 ‘쓰레기 테러’ [e글e글]
-
10
장동혁 “한동훈에 충분한 시간 주어져…징계 절차 따라 진행”
트렌드뉴스
-
1
홍준표 “김건희 도이치 굳이 무죄? 정치판 모르는 난해한 판결”
-
2
유엔사 “DMZ법, 정전협정서 韓 빠지겠다는것” 이례적 공개 비판
-
3
“담배 끊으면 60만 원”… 보건소 맞춤형 금연 코칭
-
4
장동혁, 결국 한동훈 제명…국힘 내홍 격랑속으로
-
5
배우 얼굴 가린다고…아기 폭우 맞히며 촬영, ‘학대’ 논란
-
6
화장실 두루마리 휴지는 ‘이 방향’이 맞는 이유
-
7
[속보]용산-태릉-과천 등 수도권 51곳에 6만채 공급
-
8
오천피 시대 승자는 70대 이상 장기 투자자… 20~30대 수익률의 2배
-
9
[단독]“구글스토어에 버젓이 ‘피싱 앱’, 2억 날려”… 신종 앱사기 기승
-
10
“中여성 2명 머문뒤 객실 쑥대밭”…日호텔 ‘쓰레기 테러’ [e글e글]
-
1
장동혁, 결국 한동훈 제명…국힘 내홍 격랑속으로
-
2
李 “담배처럼 ‘설탕세’ 거둬 공공의료 투자…어떤가요”
-
3
[속보]장동혁 국힘 지도부, 한동훈 제명 확정
-
4
법원 “김건희, 청탁성 사치품으로 치장 급급” 징역 1년8개월
-
5
李 ‘설탕 부담금’ 논의 띄우자…식품업계 “저소득층 부담 더 커져”
-
6
[단독]조여오는 25% 관세… “美 관보 게재 준비중”
-
7
홍준표 “김건희 도이치 굳이 무죄? 정치판 모르는 난해한 판결”
-
8
김종혁 “친한계 탈당 없다…장동혁 체제 오래 못갈것”[정치를 부탁해]
-
9
“中여성 2명 머문뒤 객실 쑥대밭”…日호텔 ‘쓰레기 테러’ [e글e글]
-
10
장동혁 “한동훈에 충분한 시간 주어져…징계 절차 따라 진행”
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0