K백신 성패 달린 임상시험, 참가자 모집 비상
- 동아일보
-
입력 2021년 3월 13일 03시 00분
공유하기
글자크기 설정
국산 코로나 백신 개발 어디까지 왔나
5개 제약사, 6개 후보물질 임상… 1곳만 2상… 나머지는 1상 머물러
백신 안맞을 사람만 임상 참여 가능… 접종 본격화될수록 모집 어려워
업계 “수백명 규모 1,2상과 달리 수만명 참여 3상은 거의 불가능”
한국도 지난달 26일 이후 신종 코로나바이러스 감염증(코로나19) 백신 접종 전선에 합류했다. 12일 0시까지 국내에서 백신을 맞은 사람은 전체 인구의 약 1% 수준인 54만6277명. 요양병원 내 65세 미만 입소자와 종사자, 코로나19 치료 의료진 등 최우선 접종 대상만 백신을 맞고 있다.
정부는 11월까지 전 국민의 70%가 백신 접종을 끝내는 ‘집단면역’을 달성하겠다는 목표를 세웠다. 하지만 코로나19 백신은 한 번 접종이 끝났다고 안심할 수 없다. 전문가들은 코로나19 백신의 항체 지속기간이 인플루엔자(독감) 백신과 유사할 것으로 본다. 짧게는 6개월, 길게는 1년 후 백신을 다시 맞아야 한다. 한국이 지금 확보한 외국산 코로나19 백신은 7900만 명분. 국내에서 코로나19 백신을 개발해야 매년 안정적인 접종이 가능해진다.
○ 해외 백신 도입에 늦춰지는 국산 백신 개발

국내 백신 개발의 가장 큰 걸림돌은 해외 백신의 국내 도입이다. 정부는 집단면역 형성을 위해 아스트라제네카 백신을 시작으로 화이자 등을 이미 도입했다. 백신 접종 속도가 붙을수록 임상 진행이 더 어려워진다.
A 제약사의 코로나19 백신 임상시험을 수행하는 한 대학병원 관계자는 “이미 임상1상부터 대상자 모집이 쉽지 않았다”고 설명했다. 국내에서 개발하는 백신 임상시험에 참여하면 1년 동안 코로나19 백신을 맞을 수 없다. 정부 계획대로 올 3분기(7∼9월) 건강한 성인이 백신 접종을 시작하면 임상 대상자 모집은 더 어려워질 것이다. 한 병원 관계자는 “국내 백신 임상시험 참여 문의가 많이 들어오지만, 만약 올해 백신을 맞고 싶다면 참여하지 말라고 권유 중”이라고 밝혔다. 지난해 12월 초 임상시험 승인을 받은 이 회사는 3개월이 지난 3월 초가 되어서야 1상 참여자 45명을 채웠다.
국내 최초이자 세계 두 번째로 코로나19 항체 치료제를 개발한 셀트리온도 임상 대상자 찾기에 어려움을 겪은 바 있다. 셀트리온이 개발한 렉키로나주는 경증과 중등증 코로나19 환자를 치료하는 약이지만, 비감염자에게 사용하면 감염 가능성을 낮출 것으로 예상됐다. 지난해 10월 렉키로나주의 코로나19 예방 효과를 검증하는 임상시험도 승인받았다. 하지만 셀트리온은 지난해 12월 임상을 포기했다. 셀트리온 관계자는 “대상자 모집이 제대로 되지 않았다”며 “곧 백신이 나올 텐데 임상에 참여할 필요가 없다는 판단을 한 것 같다”고 말했다.
○ ‘비교임상 필요’ 목소리 커져
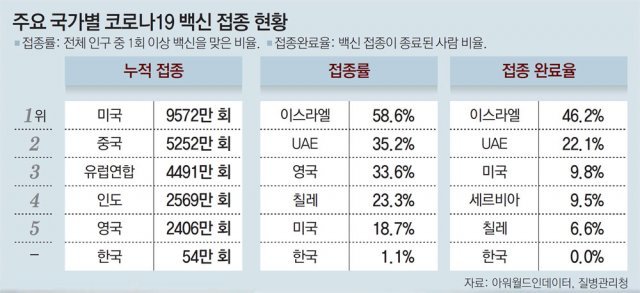
백신 임상시험에서 1, 2상은 안전성 검증 단계다. 반면 3상은 약의 효과 입증이 주된 목적이다. 대규모 참여를 받아 절반은 개발 중인 약, 나머지 절반은 가짜 약(위약)을 투여한 뒤 양쪽에서 바이러스 감염자가 얼마나 발생하는지 비교해야 한다. 이 때문에 1, 2상은 수십 명에서 수백 명 단위의 참여자가 필요하지만, 3상은 1만 명 단위의 참여자가 필요하다. 실제 미국 화이자 백신은 3만6000명, 영국 아스트라제네카 백신은 2만 명 이상의 대상자로 3상을 진행했다.
국내 코로나19 전파 상황이 대규모 임상시험에 부적합하다는 목소리도 나온다. 우정원 제넥신 연구소장은 지난달 열린 토론회에서 “한국은 코로나19 감염이 잘 통제돼 3상을 진행하기 적절하지 않다”고 말했다. 가짜 약을 맞은 사람 중 코로나19에 감염되는 사람이 어느 정도 나와 줘야 백신의 효과성을 입증할 수 있는데, 국내 상황이 그렇지 못하다는 것. 해외에서 임상을 진행하는 것도 쉽지 않다. 장인진 서울대병원 임상시험센터장은 “국내 백신이 임상3상을 시작하는 올해 하반기엔 해외 주요국 백신 접종이 상당히 진행된 상황일 것”이라고 내다봤다.
이 때문에 제약사들은 전통적인 3상 임상시험이 아닌 ‘비교임상’을 돌파구로 보고 있다. 화이자, 모더나 등 이미 판매 중인 백신과 국산 백신의 효능을 비교하는 방식으로 효과성을 입증하는 것이다. 진원생명과학 관계자는 “비교임상을 활용하면 임상 참여자 모집 부담이 줄어든다”고 설명했다.
○ 그래도 국산 백신은 만들어야
이런 상황에서도 정부 안팎에선 “그래도 국산 백신을 개발해야 한다”는 목소리가 크다. 유주헌 코로나19 치료제·백신개발 범정부지원위원회 사무국 총괄팀장은 “코로나19 이후 또 발생할 수 있는 다른 ‘팬데믹’(감염병 대유행)에 대비하기 위해서라도 이번에 백신 개발을 끝까지 완수해야 한다”고 말했다.
정부는 화이자, 모더나 등의 백신에 사용된 ‘mRNA’ 방식의 백신 개발을 위한 전문위원회를 구성했다. 아직까지 국내 코로나19 백신개발사 가운데 mRNA 방식의 백신 임상 시험에 착수한 회사는 없다. 권준욱 중앙방역대책본부 제2부본부장은 11일 브리핑에서 “(코로나19 상황에서) 가장 유망하게 활용된 mRNA 백신 플랫폼이 하필이면 우리나라에서는 가장 개발 속도가 느리다는 점이 아픈 부분”이라고 토로했다. mRNA 방식 백신은 다른 방식에 비해 효과성이 높고, 변이 바이러스 출현에도 빠르게 대처할 수 있다.
정부는 올해 코로나19 치료제와 백신 개발에 2627억 원을 투입한다. 지난해 대비 지원 규모가 20% 늘어났지만 여전히 부족하다는 지적이 나온다. 배병준 국가임상시험지원재단 이사장은 “백신 임상3상을 수행하려면 평균 2000억 원이 필요하다”며 “국가가 단순히 지원금을 주는 게 아니라 ‘투자’를 하는 방식이어야 할 것”이라고 말했다.
이지운 easy@donga.com·김소영 기자
코로나 재확산 >
구독
트렌드뉴스
-
1
UAE 배치 ‘천궁-2’, 이란 미사일 90%이상 요격…실전 첫 투입
-
2
“헤즈볼라 궤멸 기회”… 중동 확전에 뒤에서 웃는 이스라엘
-
3
‘공천헌금’ 의혹 강선우·김경 동시 구속…“증거 인멸 염려”
-
4
이세돌, ‘알파고 대국’ 10년만에 AI와 재대결
-
5
가상 무속인 내세워 ‘가스라이팅’… 87억 뜯어내
-
6
한양 고관대작들의 입맛 홀렸던 종어… ‘한국의집’에서 즐기는 봄의 성찬
-
7
“나는 절대 안 먹는다”…심장 전문의가 끊은 음식 3가지
-
8
행정통합법 1차 시한 넘긴 여야… “이번주가 진짜 데드라인”
-
9
만취女 성폭행한 세 남자…“합의하면 되나” 현장서 AI에 물었다
-
10
미스 이란 출신 모델 “하메네이 사망, 많은 국민이 기뻐해”
-
1
‘尹 훈장’ 거부한 교장…3년만에 李대통령 훈장 받고 “감사”
-
2
“정파적 우편향 사상, 신앙과 연결도 신자 가스라이팅도 안돼”
-
3
韓증시 아직 못믿나…중동전 터지자 외국인 5조원 ‘썰물’
-
4
최민희 의원, ‘재명이네 마을’서 영구 강퇴 당했다
-
5
[단독]“거부도 못해” 요양병원 ‘콧줄 환자’ 8만명
-
6
‘암살자’ B-2 이어 ‘죽음의 백조’ B-1B 떴다…美 “이란 미사일시설 초토화”
-
7
한동훈 “나를 탄핵의 바다 건너는 배로 써달라…출마는 부수적 문제”
-
8
전쟁 터지자 ‘매도 폭탄’, 코스피 5900선 붕괴…매도 사이드카 발동
-
9
나라 곳간지기에 與 4선 박홍근… ‘비명횡사’ 박용진 총리급 위촉
-
10
‘공천헌금’ 의혹 강선우·김경 동시 구속…“증거 인멸 염려”
트렌드뉴스
-
1
UAE 배치 ‘천궁-2’, 이란 미사일 90%이상 요격…실전 첫 투입
-
2
“헤즈볼라 궤멸 기회”… 중동 확전에 뒤에서 웃는 이스라엘
-
3
‘공천헌금’ 의혹 강선우·김경 동시 구속…“증거 인멸 염려”
-
4
이세돌, ‘알파고 대국’ 10년만에 AI와 재대결
-
5
가상 무속인 내세워 ‘가스라이팅’… 87억 뜯어내
-
6
한양 고관대작들의 입맛 홀렸던 종어… ‘한국의집’에서 즐기는 봄의 성찬
-
7
“나는 절대 안 먹는다”…심장 전문의가 끊은 음식 3가지
-
8
행정통합법 1차 시한 넘긴 여야… “이번주가 진짜 데드라인”
-
9
만취女 성폭행한 세 남자…“합의하면 되나” 현장서 AI에 물었다
-
10
미스 이란 출신 모델 “하메네이 사망, 많은 국민이 기뻐해”
-
1
‘尹 훈장’ 거부한 교장…3년만에 李대통령 훈장 받고 “감사”
-
2
“정파적 우편향 사상, 신앙과 연결도 신자 가스라이팅도 안돼”
-
3
韓증시 아직 못믿나…중동전 터지자 외국인 5조원 ‘썰물’
-
4
최민희 의원, ‘재명이네 마을’서 영구 강퇴 당했다
-
5
[단독]“거부도 못해” 요양병원 ‘콧줄 환자’ 8만명
-
6
‘암살자’ B-2 이어 ‘죽음의 백조’ B-1B 떴다…美 “이란 미사일시설 초토화”
-
7
한동훈 “나를 탄핵의 바다 건너는 배로 써달라…출마는 부수적 문제”
-
8
전쟁 터지자 ‘매도 폭탄’, 코스피 5900선 붕괴…매도 사이드카 발동
-
9
나라 곳간지기에 與 4선 박홍근… ‘비명횡사’ 박용진 총리급 위촉
-
10
‘공천헌금’ 의혹 강선우·김경 동시 구속…“증거 인멸 염려”
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



![합당 깬 ‘뉴이재명’ 위력… 구주류와 동거 유지 관건[광화문에서/조권형]](https://dimg.donga.com/a/464/260/95/1/wps/NEWS/FEED/Donga_Home_News2/133459020.1.thumb.jpg)


댓글 0