코오롱 골관절염 유전자 치료제, FDA “이슈 해결” 시험 재개 통보
업계 “코오롱 각종 소송에 청신호”… 식약처 “안전성 입증 의미 아니다”
“지원자 모집 난항 예상” 지적도
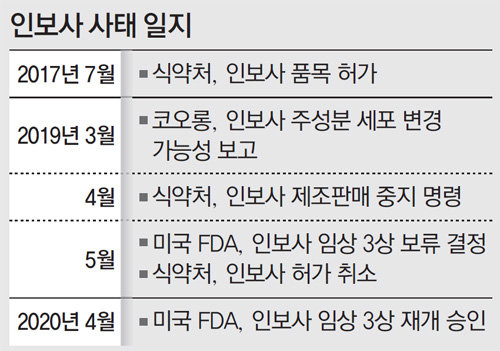
12일 코오롱생명과학은 미국 식품의약국(FDA)이 11일 자회사인 코오롱티슈진에 ‘임상 보류 해제’ 공문을 보내 “(인보사에 대한) 모든 임상 보류 이슈들이 만족스럽게 해결됐다”며 “우리는 임상 보류를 해제했으며 코오롱티슈진은 인보사의 임상시험을 진행해도 좋다”고 했다고 밝혔다.
인보사는 코오롱생명과학이 개발한 세계 최초 골관절염 세포 유전자 치료제로 코오롱생명과학의 미국 자회사인 코오롱티슈진이 개발과 현지 임상 등을 담당하고 있다. 2017년 국내 첫 유전자 치료제로 식품의약품안전처로부터 품목허가를 받았지만 지난해 당초 연골세포로 알려졌던 성분이 암을 유발할 수 있는 신장유래세포인 것으로 밝혀져 논란을 빚었다. 결국 지난해 5월 국내에서는 판매 금지 처분을, 미국 FDA에서는 임상 3상의 보류 결정을 받았다. 국내에서도, 미국에서도 약을 개발해 판매할 기회가 사라졌던 것이다.
이번 임상시험 재개가 코오롱생명과학이 진행 중인 각종 소송에 긍정적인 영향을 미칠 수 있다는 분석도 나온다. 코오롱생명과학은 △식약처 품목허가 취소 처분에 대한 행정소송 △주주 및 환자들이 제기한 민사소송 △식약처에 허위 서류를 제출한 혐의로 이우석 대표 등에 대한 검찰의 구속 기소 등 여러 건의 재판을 진행 중이다.
하지만 식약처는 인보사의 미국 내 임상시험 재개에 큰 의미를 부여하기 어렵다고 보고 있다. 신약 후보 물질을 임상시험하는 것이 약품의 유효성과 안전성이 입증됐다는 의미는 아니기 때문이다. 식약처 관계자는 “임상시험은 ‘효과가 추정된다’는 단계에서도 진행할 수 있다”고 말했다. 또 국내에서 성분 논란이 있었기에 지원자 모집 등 임상 3상에 난항이 예상된다는 지적도 있다.
여재천 한국신약개발협회 전무는 “임상시험 돌입보다는 그 결과가 어떻게 나오는지가 중요하다. 국내 품목허가 취소 등과 결부시킬 사안은 아니다”라고 말했다. 이상헌 건국대 의대 류마티스내과 교수는 “관절 안에 다른 조직세포가 들어가도 안전한지, 관절염 개선에 효능이 있는지 입증하는 것은 쉽지 않다”고 말했다.
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개
-
- 추천해요
- 개
지금 뜨는 뉴스
-

‘검찰청 내 음주’ 주장 이화영, 이번엔 검사·쌍방울 직원 고발
- 좋아요 개
- 코멘트 개
-

‘교수 사직 디데이’ 병원 떠난 빅5교수 아직 0명…환자 불안 여전
- 좋아요 개
- 코멘트 개
-

이복현 “다른 공직 갈 생각 없다…하반기면 후임 와도 무난”
- 좋아요 개
- 코멘트 개


댓글 0