식약처, 긴급 승인 절차 도입
임상시험에 대한 긴급 승인 절차가 도입돼 치료 목적의 임상시험 의약품은 신청 당일 승인을 받을 수 있게 된다. 식품의약품안전처는 8일 이런 내용이 담긴 ‘임상시험 발전 5개년 종합계획’을 발표했다.5개년 종합계획에 따르면 현재 7일 이내인 임상시험 의약품의 승인 기간을 단축해 긴급한 환자의 경우 신청 당일 처리해주기로 했다. 국내에 치료제가 없는 희귀·난치병 환자를 위한 조치다.
또 2020년부터 차등 승인제를 도입해 안전성이 확보된 임상시험은 의약품 정보, 실시 기관, 임상시험심사위원회 승인 여부 등 기본 정보만 있으면 승인해주기로 했다. 해외 임상시험 중인 약도 사용할 수 있게 된다.
유아가 참여하거나 세계에서 최초로 개발된 신약같이 위험도가 높은 임상시험을 실시하는 병원을 비롯한 기관에 대해서는 정기 점검과 품목별 특별 점검을 진행하고 점검 결과도 공개할 방침이다.
유성열 기자 ryu@donga.com
유성열 기자 ryu@donga.com
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개
-
- 추천해요
- 개
지금 뜨는 뉴스
-

김현수 “수면제 대리처방 강요-보복, 반인륜적 불법”
- 좋아요 개
- 코멘트 개
-

이준석 “차기 총리로 홍준표 적합…격에 맞는 역할 줘야”
- 좋아요 개
- 코멘트 개
-
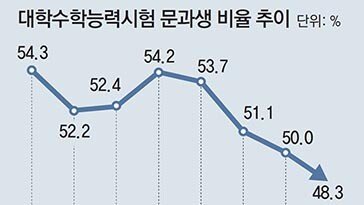
덕성여대, 독문-불문과 폐지… 인문학 소멸위기
- 좋아요 개
- 코멘트 개
댓글 0