美-中등 글로벌 제약사 개발 속도…임상 통한 부작용 확인 절차 중요
국내서도 20여개 업체 개발 착수
“돌연변이 진행 여부, 막판 변수”

○ 신약 출시는 아직… 임상 진행 중
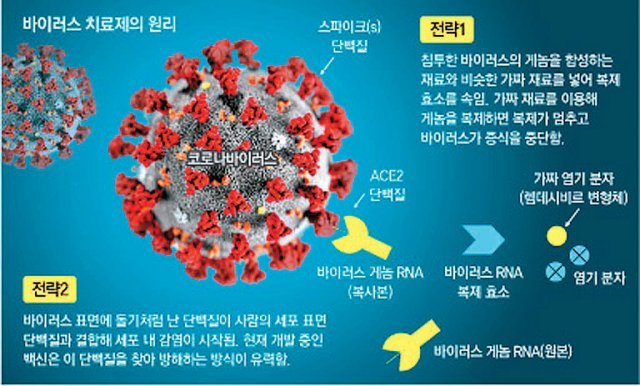
코로나 바이러스는 단일 가닥의 RNA 바이러스다. 복제도 빠르고 변이도 다양하게 일어난다. 코로나 바이러스의 후보 치료제는 이런 바이러스의 특성을 고려해 인체 내 침투와 복제, 증식, 탈피 과정 등을 방해하는 기전을 가진 물질들로 찾아볼 수 있다.
신약을 개발하기까지는 많은 시간이 걸리기 때문에 현재는 급한 대로 다른 질병에 사용하고 있는 치료제나 개발 중인 약물로 치료 효과를 알아보고 있다. 타미플루도 1999년 독감 치료제로 개발한 약인데 2009년 신종플루 치료에 효능을 인정받아 치료제로 쓰였다.
가장 많은 임상시험을 진행 중인 의약품은 미국 애브비사의 ‘칼레트라’였다. 칼레트라는 현재 국내 코로나19 중증환자들에게도 사용되고 있는 치료제다. 바이러스 증식에 반드시 필요한 바이러스 단백질 분해효소를 억제한다. 현재도 중국과 홍콩에서 총 9건의 임상시험이 진행 중이다.
그러나 뉴잉글랜드 저널 오브 메디신은 칼레트라는 199명의 환자를 대상으로 임상을 진행한 결과 심각한 코로나19로 입원한 환자의 수명을 연장하거나 바이러스를 줄이는 데 있어 통계적 유의성을 충족하지 못했다고 발표했다. 우한시에 있는 진인탄 병원의 의사들은 칼레트라가 코로나19의 표준 치료보다 더 많은 혜택을 제공하지 않는다고 결론지었다. 길리어드사이언스의 에볼라바이러스 치료제인 ‘렘데시비르’는 핵산 유사체 약물로 바이러스 RNA에 결합해 바이러스의 복제를 막는 기전이다. 예전 사스와 메르스에도 효과가 있어 임상시험에 들어갔다. 렘데시비르의 글로벌 임상은 6건이 진행 중이다. 다음 달 중국 임상 결과가 나올 예정이다. 만약 임상 3상에 성공하면 이르면 5월 신약이 출시될 수 있다.
말라리아 치료제인 클로로퀸은 말라리아바이러스와 세포 융합에 필요한 엔도솜 pH를 증가시키고 숙주세포의 표면 수용체인 ACE2의 말단의 당화를 방해해 말라리아 바이러스와 숙주세포와의 결합을 막는 기전을 가진다. 사스 바이러스도 숙주세포의 ACE2와 결합하기 때문에 클로로퀸을 코로나19 치료제로 활용하기 위한 임상시험도 진행 중이다.
치료제가 나온다고 해도 준비해야 할 것은 많다. 독감 유행 시즌에도 타미플루 성분이 일시적으로 공급에 어려움을 겪는다. 노민수 약사(미바이오텍·애드닥터스 대표이사)는 “원활한 국내 유통을 위해서는 안전성이 확보된 제품에 대해서 허가나 급여의 신속 검토, 면제 방안 등을 고려해야 한다”며 “현재 코로나19 치료제는 개발된다 하더라도 전 세계 국가가 모두 필요한 상황인 만큼 국내에는 한정된 물량만 들어올 수 있다”고 말했다. 노 약사는 “수입된 물량에서 우선 제공해야 하는 환자군을 정해놓는 등 혼란을 줄이는 방안도 사전에 준비해야 할 일”이라고 말했다.
○ WHO “20가지 백신 개발중… 이례적인 속도”
결국 답은 백신에 있다. 세계보건기구(WHO)는 최소 20가지의 백신이 개발되고 있다는 소식을 전했다. 백신 개발 과정이 이렇게 빠른 것은 전례 없는 일이다. 그러나 백신의 상용화까지는 꽤 오랜 시간이 걸릴 것으로 보인다. 급박한 상황이더라도 부작용을 찾아내고 안전성을 확인하는 것이 중요하기 때문이다.
백신 개발에서는 미국이 앞서 나가고 있다. 미국 제약사 모더나는 미국 국립보건원(NIH)과 공동 개발한 코로나19 백신의 임상 1상을 16일 시작했다. 총 6주간 45명의 참가자와 진행한다. 실험의 목적은 백신을 인체에 투여했을 때 우려할만한 부작용이 발생하는지 확인하기 위한 것이다.
오인석 약사(대한약사회 학술이사)는 “바이러스의 유전자 코드만을 활용해서 백신을 만드는 방식은 최신 기술”이라며 “체내에 유전자 코드를 주입해 해당 유전자를 가진 침입자가 몸 안에 들어오면 대항해 싸울 수 있게 만드는 것”이라고 말했다. 모더나의 효과가 입증되면 상용화까지는 1년에서 18개월까지 걸릴 예정이다.
한편 미국 이노비오와 독일의 큐어백도 각각 4월과 6월 임상 1상을 시작할 계획이다. 중국도 백신 개발에 속도를 내고 있다. 중국 군사의학과학원의 백신 연구팀은 16일 재조합 코로나19 백신 임상 승인을 받았다. 현재 코로나19 백신 개발에 착수한 중국 바이오 기업은 20곳 이상인 것으로 알려졌다.
국내 업체들도 치료제와 백신 개발을 시작했다. 한국제약바이오협회에 따르면 국내 제약·바이오 기업 15곳과 정부기관 4곳이 치료제와 백신 개발에 나섰다.
오 약사는 “코로나19 바이러스는 단일가닥 RNA 바이러스로 변이율이 높다”며 “벌써 돌연변이가 생겼을 것”이라고 말했다. 그는 “향후 개발될 백신으로 어느 정도의 돌연변이까지 막아낼 수 있을지 모르지만 병원성이 있는 바이러스의 공격을 막아내기 위해서는 백신의 개발이 무엇보다 중요하다”고 강조했다.
홍은심 기자 hongeunsim@donga.com
홍은심 기자 hongeunsim@donga.com
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개
-
- 추천해요
- 개
지금 뜨는 뉴스
-

보조금 28억씩 챙긴뒤 사라지는 여야 위성정당
- 좋아요 개
- 코멘트 개
-

지하철 범죄 3546건 12년새 최다… 보안관은 체포권 없어
- 좋아요 개
- 코멘트 개
-

日외교청서 ‘독도 영유권’ 억지… 韓 “즉각 철회하라”
- 좋아요 개
- 코멘트 개
댓글 0